Transfert en cours..., vous êtes sur le "nouveau" serveur data.abuledu.org dont l'hébergement est financé par l'association abuledu-fr.org grâce à vos dons et adhésions !
Vous pouvez continuer à soutenir l'association des utilisateurs d'AbulÉdu (abuledu-fr.org) ou l'association ABUL.
Suivez la progression de nos travaux et participez à la communauté via la liste de diffusion.
Votre recherche ...
Nuage de mots clés
Dessins et plans, Chimie, Antiseptiques, Essences forestières, Essences végétales, Monoterpènes, Terpènes
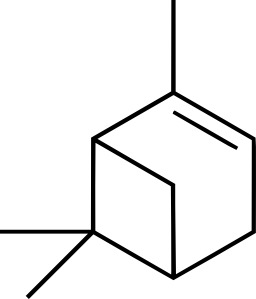
Alpha-pinène
L'alpha-pinène (α-pinène) est un monoterpène bicyclique. Il a pour isomère le bêta-pinène. Il est connu pour ses propriétés antiseptiques. Il peut aussi être prescrit en cas d'hypersécrétion bronchique. La molécule d'α-pinène ressemble à celle du camphre sans atome d'oxygène. Même si l’essence de pin se trouve dans la nature, on la prépare par l’action d’un acide sur l’α-pinène, ce qui le transforme en α-terpinéol (C10H18O), constituant majoritaire de l’essence de pin et la molécule responsable de l’odeur du genièvre. Il est présent dans de nombreuses plantes, comme la menthe, la lavande, la sauge et le gingembre. On la trouve également dans l'essence de térébenthine.
Photographie, Tennis de table, Dix-neuvième siècle, Matières plastiques, Chimie, Inventions, Celluloïd
Balles de ping pong en celluloïd
Balles de ping pong en celluloïd. Le celluloïd est le nom donné à une matière composée essentiellement de nitrate de cellulose et de camphre. Elle est considérée comme la toute première matière plastique artificielle dont l'origine remonte à 1856. Sa composition a été petit à petit améliorée pour la rendre finalement facile à modeler et à produire. Son invention revient le plus souvent aux frères Hyatt en 1870. Le celluloïd est très inflammable et n'est quasiment plus utilisé aujourd'hui.
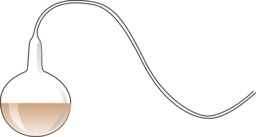
Col de cygne
Ballon à « col de cygne » de Louis Pasteur (1822-1895) : dans un nombre appréciable de cas, l'air qui a traversé les sinuosités, sans avoir été ni chauffé, ni filtré ni lavé, ne provoque pas l'apparition d'êtres vivants sur les substances qui se trouvent au fond du flacon, alors qu'il la provoque sur une goutte placée à l'entrée du circuit. La seule explication de l'inaltération du fond est que des germes ont été arrêtés par les sinuosités et se sont déposés sur le verre. Cette expérience avait été suggérée à Pasteur par le chimiste Balard.
Gravure, Glace, Cristaux, Chimie, Cristaux de neige, Chimie -- Étude et enseignement, Cristaux -- Structure
Cristaux de neige et de glace
Détail (Figure 1) de la page 7 des ''Leçons élémentaires de chimie'' (1897), de Bussard et Dubois - Diverses formes des cristaux de neige et de glace.
Photographie, Pyrite, Géographie, Carrières (exploitations minières), Chimie, Lordat (Ariège), Talc, Pyrite -- Gisements
Cristaux de Pyrite de la mine de talc de Trimouns
Cristaux de Pyrite de la mine de talc de Trimouns à Luzenac dans l'Ariège.
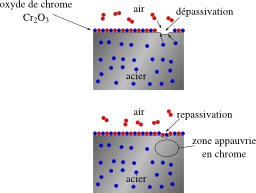
Métaux, Dessins et plans, Physique, Corrosion, Chimie, Acier inoxydable, Air, Air -- Humidité, Passivation (chimie), Passivité (chimie)
Dépassivation et repassivation de l'inox
Dépassivation (rupture de la couche d'oxyde) et repassivation d'un acier inoxydable : les atomes de chrome dans l'acier réagissent avec le dioxygène de l'air et forment une couche protectrice d'oxyde de chrome. La passivation ou passivité représente un état des métaux ou des alliages dans lequel leur vitesse de corrosion est notablement ralentie par la présence d'un film passif naturel ou artificiel, par rapport à ce qu'elle serait en l'absence de ce film. Dans la plupart des cas (aluminium, acier, acier inoxydable, titane…), ce film passif apparait spontanément par oxydation, parce que l'oxyde formé sur la surface est insoluble et constitue un obstacle qui ralentit les processus ultérieurs. Dans un milieu aqueux, la formation de ce film est liée à un domaine de potentiel électrochimique ainsi qu'à un domaine de pH dans lesquels l'oxyde est stable. De ce fait, on s'attache à ce que le film passif se forme à l'air avant la mise en service de la pièce.
Photographie, Dolomite, Géographie, Carrières (exploitations minières), Chimie, Lordat (Ariège), Talc
Dolomite et talc de Luzenac
Dolomite (en haut à gauche) et Talc (en bas au centre) de la carrière de talc de Trimouns, Luzenac, Ariège, Midi-Pyrénées (10x6.2cm).
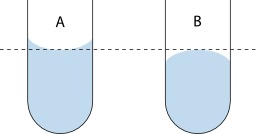
Lecture du ménisque concave d'eau colorée
Lecture du ménisque concave d'eau colorée dans une burette.
Ménisque de l'eau
Schéma du ménisque de l'eau au niveau moléculaire. Le ménisque est la surface courbe d'un liquide ; il apparaît en réponse à la surface du contenant ou d'un autre objet. La mesure précise d'un volume de solution aqueuse à l'aide d'une burette utilise la méthode du ménisque concave.
Ménisque de l'eau
Lecture du ménisque de l'eau : A : le ménisque est orienté vers le bas, il est concave ; B : le ménisque est orienté vers le haut, il est convexe.
Photographie, Cuivre, Chimie, Affinage, Cuivre -- Électrométallurgie, Électrolyse, Sels de cuivre, Sulfate de cuivre, Teneur en cuivre
Métal pur de cuivre
Disque de cuivre presque pur (99,95%) : macro, diamètre de 83 mm. Le cuivre devient pâteux vers 830 °C et fond autour de 1 100 °C (voir température de fusion : 1 084,45 °C). L'affinage industriel du cuivre s'effectue par électrolyse d'anodes de cuivre brut dans une solution de sulfate de cuivre. Les ions cuivre migrent vers la cathode et les impuretés restent dans le bain. Ce procédé permet d'obtenir du métal pur à 99,95 %.
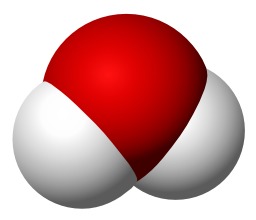
Molécule d'eau en 3D
Molécule d'eau en 3D : Représentation schématique d'une molécule d'eau avec en rouge l'atome d'oxygène et en blanc les deux atomes d'hydrogène.
Photographie, Molécules, Chimie, Origami, Pliages en papier, Produits de bricolage, Ammoniac, Molécules -- Structure
Molécule de l'ammoniac en origami
Molécule de l'ammoniac en origami, créée par Belén Garrido, pliage d'Archivaldo.
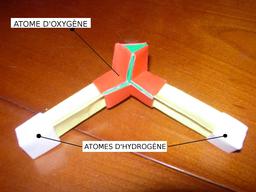
Photographie, Eau, Atomes, Hydrogène, Molécules, Oxygène, Chimie, Origami, Pliages en papier, Produits de bricolage, Chimie -- Modèles
Molécule de l'eau en origami
Molécule de l'eau en origami, créée par Belén Garrid : un atome d'oxygène et deux atomes d'hydrogène.
Nodule de silex éclaté
Fragments et éclats de silex (Feuerstein = pierre à feu, en allemand). Ils sont coupants et cassants quand ils sont fins. Les nodules de silex sont enveloppés d'une gangue plus ou moins épaisse nommée « cortex » et composée d'impuretés (dépôts organiques, etc.) repoussées vers l'extérieur lors de la croissance du silex.
Particules de suie autour de la Terre
Cliché pris par la NASA en décembre 2009 montrant les particules de suie autour de la Terre. Connu sous le nom de suie, le noir de carbone entre dans l'air par combustion incomplète du charbon, du bois et du diesel. Le noir de carbone est l'un des polluants de l'air quand il est émis par les pots d'échappement (des moteurs Diesel principalement) et par la combustion domestique ; à l'horizon 2020, dans la CEE, les petits appareils de chauffage des habitations deviendront la principale source d’émission de noir de carbone et produiront à peu près la moitié des émissions totales ; cette tendance pourrait s’accentuer si la combustion de la biomasse est préconisée comme mesure de protection du climat. L'usure des pneus sur les routes libère également du noir de carbone. C'est peut-être un produit cancérogène.
Poudre de silicium
Poudre de silicium. C'est l'élément le plus abondant dans la croûte terrestre après l'oxygène (25,7 % de sa masse), mais il est quasiment absent de la matière constituant le vivant. Il n'existe pas à l'état libre, mais sous forme de composés : sous forme de dioxyde de silicium (SiO2), la silice (dans le sable, le quartz, la cristobalite, etc.), ou d'autres silicates. Il est utilisé depuis très longtemps sous forme d'oxyde de silicium amorphe (silice ou SiO2) comme composant essentiel du verre. Il a depuis le milieu XXe siècle de nouveaux usages en électronique (transistor), pour la production de matériaux tels que les silicones ou, pour fabriquer des panneaux solaires photovoltaïques.
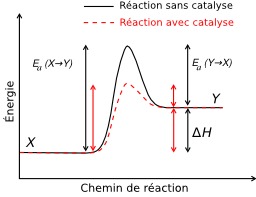
Réaction avec et sans catalyse
Illustration d'un changement d'énergie d'activation causée par une catalyse. Effet d'un catalyseur positif sur l'énergie d'activation d'une réaction : elle est plus faible et la vitesse de réaction augmente. Source : original créé par Bkel, en vectorisant l'image de Vinay.bhat, qui détient le copyright mais a relâché les droits.
Photographie, Géographie, Carrières (exploitations minières), Chlorites, Chimie, Cristallographie, Lordat (Ariège), Macles (cristallographie), Rutile
Rutile sur chlorite
Rutile (macle en genou) et Clinochlore : Mine de talc de Trimouns à Luzenac, Ariège, Midi-Pyrénées.
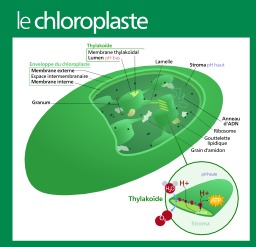
Dessins et plans, Cycle du carbone, Photons, Chloroplastes, Chimie, Biologie, Cycle du carbone (biogéochimie)
Schéma d'un Chloroplaste
Schème de chloroplaste d'une plante supérieure. Les chloroplastes sont des organites présents dans le cytoplasme des cellules eucaryotes photosynthètique (plantes, algues). Ils sont sensibles aux expositions des différentes ondes du spectre lumineux. Ils jouent un rôle essentiel dans le fonctionnement d'une cellule végétale car ils permettent de capter la lumière à l'origine de la photosynthèse. Par l'intermédiaire de la chlorophylle qu'ils possèdent et de leurs ultrastructures, ces organites sont capables de transférer l'énergie véhiculée par les photons à des molécules chimiques (eau). Les chloroplastes jouent un rôle important dans le cycle du carbone, par la transformation du carbone atmosphérique en carbone organique. Les chloroplastes appartiennent à une famille d'organites appelés les plastes ; ceux-ci sont le fruit de l'endosymbiose d'une cyanobactérie, il y a environ 1,5 milliard d'années.
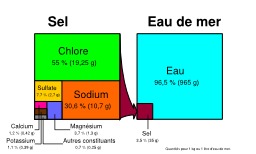
Dessins et plans, Océans, Chimie, Sel, Eau de mer, Eau de mer -- Analyse, Eau de mer -- Biochimie, Eau de mer -- Composition, Eau de mer -- Microbiologie, Eaux salées
Sels de mer
Proportions des "sels" dans l'eau de mer, et composition chimique du sel. Source : Hannes Grobe, Alfred Wegener Institute for Polar and Marine Research, Bremerhaven, Allemagne ; SVG version par Stefan Majewsky ; traduction par Korrigan.
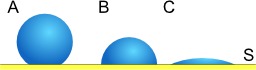
Dessins et plans, Liquides, Physique, Gouttes, Solides, Chimie, Gouttes -- Dimensions, Mouillage (chimie des surfaces)
Tension superficielle de gouttes
Gouttes de trois liquides en contact avec une surface : tension superficielle et mouillage. Dans le cas où l'une des phases est solide (jaune), ce phénomène s'appelle mouillage et on appelle angle de contact l'angle entre l'interface fluide/fluide et la surface solide. Cet angle de contact est donné par la Loi de Young-Dupré. La qualité du mouillage d'un liquide sur un solide est le degré d'étalement du liquide sur ce solide. On parle de mouillage total lorsque le liquide s'étale totalement, et de mouillage partiel lorsque le liquide forme une goutte sur le solide. Le type de mouillage (total ou partiel) est déterminé par le signe du coefficient d'étalement.
Photographie, Cuivre, Toits, Chimie, Architecture, Toits en cuivre, Sulfate de cuivre, Étanchéité, Minneapolis (Minn.), Revêtements d'étanchéité, Toitures
Toiture en cuivre patiné
Toiture en cuivre patiné de la mairie de Minnéapolis (USA). Alors que, pour les applications électriques, on utilise du cuivre non oxydé, le cuivre utilisé en architecture est du cuivre phosphoreux désoxydé (également nommé Cu-DHP). Depuis l’antiquité, on utilise le cuivre comme matériau de couverture étanche, ce qui donne à nombre de bâtiments anciens l’aspect vert de leurs toitures et coupoles. Au début se forme de l’oxyde de cuivre, bientôt remplacé par du sulfure cuivreux et cuivrique, et enfin par du carbonate de cuivre. La patine finale de sulfate de cuivre (dénommée vert-de-gris) est très résistante à la corrosion.