Transfert en cours..., vous êtes sur le "nouveau" serveur data.abuledu.org dont l'hébergement est financé par l'association abuledu-fr.org grâce à vos dons et adhésions !
Vous pouvez continuer à soutenir l'association des utilisateurs d'AbulÉdu (abuledu-fr.org) ou l'association ABUL.
Suivez la progression de nos travaux et participez à la communauté via la liste de diffusion.
Votre recherche ...
Nuage de mots clés
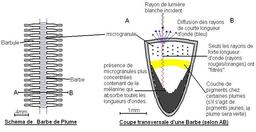
Diffusion de Rayleigh dans une plume
Schéma du phénomène de diffusion de Rayleigh dans une plume : les mélanines diffusent les courtes longueurs d'onde ; il y a donc des plumes bleues sans pigments bleus ! La plupart des oiseaux disposant de plumes vertes ou bleues, comme les espèces du genre Pavo, ne synthétisent pas de pigments de ces couleurs1. Ceci n'est possible que grâce à l'effet Tyndall. La couleur se visualise sur les ramifications latérales de la plume appelées barbes, les cellules la constituant peuvent contenir des microgranules à l'origine de ce phénomène. En effet, les rayons incidents à la plume rencontrent des microgranules de mélanine (noire) de très petite taille et peu concentrées, ces microgranules réfléchissent donc les ondes bleues et laissent filtrer les rayons à grande longueur d'onde. Une partie de ces rayons peut être réfléchie par des pigments situés sous les microgranules (cas des plumes vertes qui contiennent des pigments jaunes), le reste des longueurs d'onde est absorbé par des microgranules très concentrées. Ainsi la plume ne présente pas le même ton de couleur selon l'angle (phénomène d'irisation), et de dos la plume est de couleur noire (la couleur de la mélanine). Ce phénomène est semblable aussi pour la coloration des yeux chez l'homme.