Transfert en cours..., vous êtes sur le "nouveau" serveur data.abuledu.org dont l'hébergement est financé par l'association abuledu-fr.org grâce à vos dons et adhésions !
Vous pouvez continuer à soutenir l'association des utilisateurs d'AbulÉdu (abuledu-fr.org) ou l'association ABUL.
Suivez la progression de nos travaux et participez à la communauté via la liste de diffusion.
Votre recherche ...
Nuage de mots clés
Dessins et plans, Lumière, Lumière -- Propagation, Matière, Ondes électromagnétiques, Absorption, Lumière -- Absorption, Physique nucléaire, Transfert d'énergie
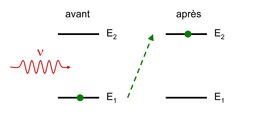
Absorption entre niveaux atomiques
Processus d'interaction entre la lumière et la matière : illustration du phénomène d'absorption entre les niveaux atomiques : Le photon d'énergie h u fait passer l'atome de son état fondamental 1 vers l'état excité 2. Lorsqu'il est éclairé par un rayonnement électromagnétique (la lumière), un atome peut passer d'un état n à un état n' > n, en prélevant l'énergie correspondante sur le rayonnement. Ce processus est résonnant : la fréquence du rayonnement omega doit être proche d'une fréquence de Bohr atomique pour qu'il puisse se produire. Les fréquences de Bohr atomiques sont définies par hbaromega_{nn'}=(E_{n'}-E_n), où E_{n'} > E_n sont les énergies des états n' et n. On peut interpréter ce processus comme l'absorption d'un photon du rayonnement (d'énergie hbaromega=h u) faisant passer l'atome du niveau d'énergie E_n vers le niveau d'énergie E_{n'}. La condition de résonance correspond alors à la conservation de l'énergie.
Atome stylisé de lithium
Le lithium est un élément chimique, de symbole Li et de numéro atomique 3. Dans le tableau périodique des éléments, il est situé dans le groupe 1, parmi les métaux alcalins. Comme tous les métaux alcalins, il est très réactif et est généralement conservé dans de l'huile minérale pour le préserver de l'air. Le lithium pur est un métal mou, de couleur blanc argenté, qui se ternit et s'oxyde très rapidement au contact de l'air et de l'eau, prenant une teinte grise virant rapidement à l'anthracite et au noir. C'est l'élément solide le plus léger. Il est essentiellement utilisé pour réaliser des verres et des céramiques réfractaires, des alliages à la fois légers et résistants pour l'aéronautique, et surtout des piles au lithium et des batteries au lithium. Les noyaux des deux isotopes stables du lithium comptent parmi les noyaux atomiques ayant l'énergie de liaison par nucléon la plus faible de tous les isotopes stables, ce qui signifie que ces noyaux sont en fait assez peu stables comparés à ceux des autres éléments légers. C'est pourquoi ils peuvent être utilisés dans des réactions de fission nucléaire comme de fusion nucléaire. C'est également la raison pour laquelle le lithium est moins abondant dans le Système solaire que 25 des 32 éléments chimiques les plus légers. Le lithium joue par conséquent un rôle important en physique nucléaire. La transmutation d'atomes de lithium en tritium a été la première réaction de fusion nucléaire artificielle, et le deutérure de lithium est le combustible de la bombe H.