Transfert en cours..., vous êtes sur le "nouveau" serveur data.abuledu.org dont l'hébergement est financé par l'association abuledu-fr.org grâce à vos dons et adhésions !
Vous pouvez continuer à soutenir l'association des utilisateurs d'AbulÉdu (abuledu-fr.org) ou l'association ABUL.
Suivez la progression de nos travaux et participez à la communauté via la liste de diffusion.
Votre recherche ...
Nuage de mots clés
Photographie, Cuivre, Chimie, Affinage, Cuivre -- Électrométallurgie, Électrolyse, Sels de cuivre, Sulfate de cuivre, Teneur en cuivre
Métal pur de cuivre
Disque de cuivre presque pur (99,95%) : macro, diamètre de 83 mm. Le cuivre devient pâteux vers 830 °C et fond autour de 1 100 °C (voir température de fusion : 1 084,45 °C). L'affinage industriel du cuivre s'effectue par électrolyse d'anodes de cuivre brut dans une solution de sulfate de cuivre. Les ions cuivre migrent vers la cathode et les impuretés restent dans le bain. Ce procédé permet d'obtenir du métal pur à 99,95 %.
Photographie, Cuivre, Toits, Chimie, Architecture, Toits en cuivre, Sulfate de cuivre, Étanchéité, Minneapolis (Minn.), Revêtements d'étanchéité, Toitures
Toiture en cuivre patiné
Toiture en cuivre patiné de la mairie de Minnéapolis (USA). Alors que, pour les applications électriques, on utilise du cuivre non oxydé, le cuivre utilisé en architecture est du cuivre phosphoreux désoxydé (également nommé Cu-DHP). Depuis l’antiquité, on utilise le cuivre comme matériau de couverture étanche, ce qui donne à nombre de bâtiments anciens l’aspect vert de leurs toitures et coupoles. Au début se forme de l’oxyde de cuivre, bientôt remplacé par du sulfure cuivreux et cuivrique, et enfin par du carbonate de cuivre. La patine finale de sulfate de cuivre (dénommée vert-de-gris) est très résistante à la corrosion.
Cristaux bleus
Photo de cristal bleu : sulfate de cuivre hydraté (CuSO4, 5 H2O) ; Nom du minéral : Chalcantite.
Dôme en cuivre neuf et ancien
Dôme en cuivre de la tour de l'Observatoire Royal d'Edinburgh en Écosse, après remise à neuf en octobre 2010 : La couleur du cuivre neuf fait contraste avec celui d'origine (patine de sulfate de cuivre, vert-de-gris) qui remonte à 1894.
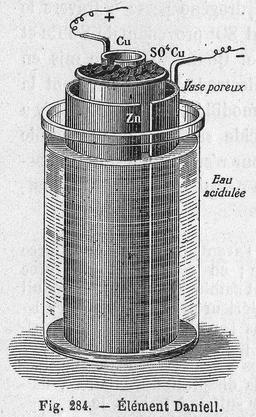
Élément Daniell
Illustration d'un élément de pile électrique Daniell. Source : Leçons de Physique ; Éditions Vuibert et Nony, 1904. La pile Daniell a été inventée par le chimiste britannique John Daniell en 1836 au moment où le développement du télégraphe faisait apparaître un besoin urgent de sources de courant sûres et constantes. La pile électrique Daniell est constituée d'une anode (lame de zinc plongée dans une solution contenant du sulfate de zinc) et d'une cathode (lame de cuivre plongée dans une solution contenant du sulfate de cuivre). Les deux solutions sont reliées par un pont salin (solution de chlorure de potassium (KCl)) qui sert à équilibrer les charges.
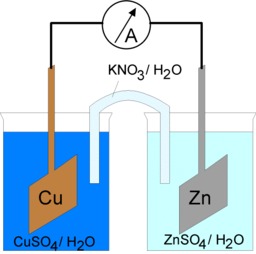
Le pont salin de Daniell
Schéma de principe d'un élément Daniell : Dans le pont électrolytique (ou pont salin), deux ions chlorure (Cl^-) dérivent vers la solution de sulfate de zinc ; alors que deux ions potassium (K^+) traversent le pont salin pour rééquilibrer la solution de cuivre. Le pont électrolytique sert ainsi à fermer le circuit électrique, tout en assurant aux deux demi-piles des potentiels différents.
Montage de pont salin (Daniell)
Manipulation autour d'un montage avec un pont salin : pile Daniell qui débite. Dans le pont électrolytique (ou pont salin), deux ions chlorure (Cl^-) dérivent vers la solution de sulfate de zinc ; alors que deux ions potassium (K^+) traversent le pont salin pour rééquilibrer la solution de cuivre. Le pont électrolytique sert ainsi à fermer le circuit électrique, tout en assurant aux deux demi-piles des potentiels différents.