Transfert en cours..., vous êtes sur le "nouveau" serveur data.abuledu.org dont l'hébergement est financé par l'association abuledu-fr.org grâce à vos dons et adhésions !
Vous pouvez continuer à soutenir l'association des utilisateurs d'AbulÉdu (abuledu-fr.org) ou l'association ABUL.
Suivez la progression de nos travaux et participez à la communauté via la liste de diffusion.
Votre recherche ...
Nuage de mots clés
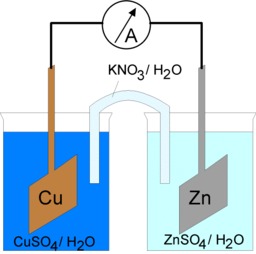
Le pont salin de Daniell
Schéma de principe d'un élément Daniell : Dans le pont électrolytique (ou pont salin), deux ions chlorure (Cl^-) dérivent vers la solution de sulfate de zinc ; alors que deux ions potassium (K^+) traversent le pont salin pour rééquilibrer la solution de cuivre. Le pont électrolytique sert ainsi à fermer le circuit électrique, tout en assurant aux deux demi-piles des potentiels différents.
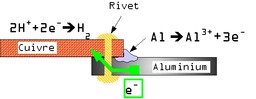
Corrosion galvanique
Corrosion galvanique, exemple d'un assemblage par rivet entre une tôle d'aluminium et de cuivre sans isolation. Une pile électrochimique est créée lorsque deux métaux de natures différentes sont mis en contact. Un des métaux s'oxyde et se dissout (anode), tandis que sur l'autre métal a lieu une réduction (cathode), et éventuellement formation d'une couche de produits de réaction (des espèces chimiques de la solution se réduisent et se déposent, notamment dépôt calco-magnésien). On parle de corrosion galvanique. Ce phénomène explique : le principe de la « protection cathodique par anode sacrificielle » : on crée une pile électrochimique qui impose un sens de parcours aux électrons pour empêcher la réaction de corrosion ; l'anode se dissout (elle est sacrifiée) et la cathode reste stable, elle est de plus parfois protégée par une couche de produits de réaction ; le principe de la « protection cathodique par courant imposé » : à la place de l'anode sacrificielle, on peut imposer le sens de parcours des électrons en établissant une différence de potentiel entre la pièce et le milieu avec un générateur de tension, par exemple alimenté par des panneaux solaires ; ce phénomène explique aussi pourquoi lorsque l'on met deux métaux différents en contact, l'un se corrode très rapidement. C'est exactement le même type de réactions chimiques qui ont lieu dans une pile d'alimentation électrique, une batterie ou un accumulateur.