Transfert en cours..., vous êtes sur le "nouveau" serveur data.abuledu.org dont l'hébergement est financé par l'association abuledu-fr.org grâce à vos dons et adhésions !
Vous pouvez continuer à soutenir l'association des utilisateurs d'AbulÉdu (abuledu-fr.org) ou l'association ABUL.
Suivez la progression de nos travaux et participez à la communauté via la liste de diffusion.
Votre recherche ...
Nuage de mots clés
Photographie, Molécules, Chimie, Origami, Pliages en papier, Produits de bricolage, Ammoniac, Molécules -- Structure
Molécule de l'ammoniac en origami
Molécule de l'ammoniac en origami, créée par Belén Garrido, pliage d'Archivaldo.
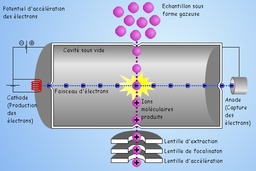
Ionisation électronique
Spectromètrie de masse à source d'ionisation électronique, légendé en français : La spectrométrie de masse est une technique physique d'analyse permettant de détecter et d'identifier des molécules d’intérêt par mesure de leur masse, et de caractériser leur structure chimique. Son principe réside dans la séparation en phase gazeuse de molécules chargées (ions) en fonction de leur rapport masse/charge (m/z). Le spectromètre de masse, initialement conçu par le Britannique Joseph John Thomson, comporte une source d'ionisation suivie d'un ou plusieurs analyseurs qui séparent les ions produits selon leur rapport m/z, d'un détecteur qui compte les ions et amplifie le signal, et enfin d'un système informatique pour traiter le signal.
Dessins et plans, Lumière solaire, Lumière, Lumière -- Propagation, Lumière, Théorie ondulatoire de la, Ondes électromagnétiques, Ondes électromagnétiques -- Propagation, Ondes porteuses, Spectres
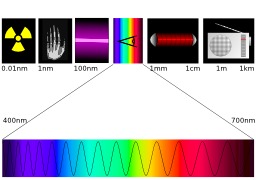
Le spectre électromagnétique
Proposition d'illustration du spectre électromagnétique, le spectre visible correspond aux couleurs en bas du schéma. La lumière visible, appelée aussi spectre visible ou spectre optique est la partie du spectre électromagnétique qui est visible pour l'œil humain. Il n'y a aucune limite exacte au spectre visible : l'œil adapté à la lumière possède généralement une sensibilité maximale à la lumière de longueur d'onde d'environ 550 nm, ce qui correspond à une couleur jaune-verte. Généralement, on considère que la réponse de l'œil couvre les longueurs d'ondes de 380 nm à 780 nm bien qu'une gamme de 400 nm à 700 nm soit plus commune. Les fréquences correspondantes vont de 350 à 750 THz (10¹² Hz). Cette gamme de longueur d'onde est importante pour le monde vivant car des longueurs d'ondes plus courtes que 380 nm endommageraient la structure des molécules organiques tandis que celles plus longues que 720 nm seraient absorbées par l'eau, constituant abondant du vivant. Ces extrêmes correspondent respectivement aux couleurs violet et rouge. Cependant, l'œil peut avoir une certaine réponse visuelle dans des gammes de longueurs d'onde encore plus larges. Les longueurs d'onde dans la gamme visible pour l'œil occupent la majeure partie de la fenêtre optique, une gamme des longueurs d'onde qui sont facilement transmises par l'atmosphère de la Terre.
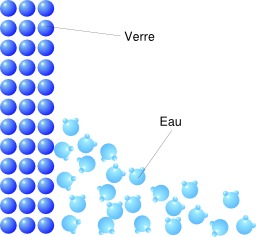
Ménisque de l'eau
Schéma du ménisque de l'eau au niveau moléculaire. Le ménisque est la surface courbe d'un liquide ; il apparaît en réponse à la surface du contenant ou d'un autre objet. La mesure précise d'un volume de solution aqueuse à l'aide d'une burette utilise la méthode du ménisque concave.
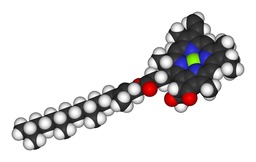
Molécule de Chlorophylle a
Molécule de chlorophylle a. En vert : magnésium ; en bleu : azote ; en noir : carbone ; en blanc : hydrogène ; en rouge : oxygène.
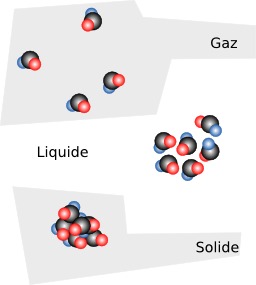
Molécules d'un solide, d'un liquide et d'un gas
Molécules à l'état solide, liquide et gazeux. Diagramme montrant comment sont configurés les molécules et les atomes pour les différents états de la matière.
Dessins et plans, Populations, Écosystèmes, Biosphère, ADN, Biocénoses, Biocénoses -- Structure trophique, Biomes, Communautés, Compétition entre individus (biologie), Molécules, Organes, Paysages, Plantes -- Populations, Théories du vivant, Vie (biologie)
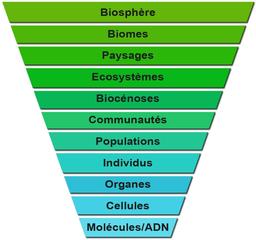
Niveau d'Organisation et d'Intégration du Vivant
Graphique représentant les différents niveaux d'organisation ou d'intégration du vivant. Il ne s'agit pas d'une hiérarchie, mais d'une présentation simplifiée, des niveaux étudiés par les biologistes et écologues : biosphère, biomes, paysages, écosystèmes, biocénoses, communautés, populations, individus, organes, cellules, molécules/ADN.
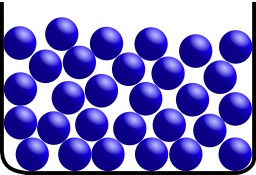
Structure moléculaire d'un liquide
Structure moléculaire d'un liquide : La phase liquide est un état de la matière. Sous cette forme, la matière est facilement déformable mais difficilement compressible. Le liquide est une forme de fluide : les molécules sont faiblement liées, ce qui rend les liquides parfaitement déformables. Mais, à l'inverse du gaz, elles sont tout de même liées : une molécule ne peut s'éloigner beaucoup d'une autre, ce qui fait que la matière liquide a une cohésion que ne possède pas le gaz (et comme dans les solides, les molécules sont très proches les unes des autres, ce qui rend les liquides difficilement compressibles). Chaque atome est en contact avec de nombreux voisins mais aucun ordre n'apparait.