Transfert en cours..., vous êtes sur le "nouveau" serveur data.abuledu.org dont l'hébergement est financé par l'association abuledu-fr.org grâce à vos dons et adhésions !
Vous pouvez continuer à soutenir l'association des utilisateurs d'AbulÉdu (abuledu-fr.org) ou l'association ABUL.
Suivez la progression de nos travaux et participez à la communauté via la liste de diffusion.
Votre recherche ...
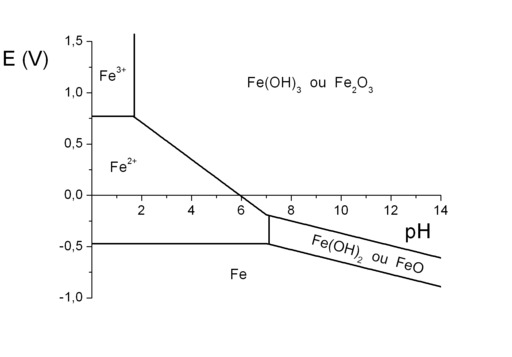
Diagramme potentiel pH du fer
Description de la ressource
Diagamme potentiel-pH (diagramme de Pourbaix) de l'élément fer à 25°C en milieu aqueux (simplifié). La stabilité du fer dans l'eau dépend : du pH, qui détermine la concentration d'ions H3O+ dans l'eau ; du potentiel électrique de la pièce en fer par rapport à la solution, qui détermine la capacité des électrons à quitter le fer. On peut ainsi tracer un diagramme potentiel-pH (E, pH), en indiquant les zones de stabilité du fer (Fe), les zones de stabilité de l'ion Fe2+ (ou « ion fer II »), les zones de stabilité de l'ion Fe3+ (ou « ion fer III ») et les zones de passivation. Il s'agit donc d'une sorte de « carte », les zones délimitées par des frontières indiquant les couples de valeurs (E, pH) pour lesquelles une espèce est stable. Ce diagramme porte le nom de diagramme de Pourbaix, et peut être tracé pour tous les métaux. Pour savoir si un matériau est adapté à un milieu, il suffit de regarder le diagramme de Pourbaix de ce matériau. Si le couple (E, pH) se situe dans une zone de stabilité, le matériau est protégé contre la corrosion généralisée.
Détails de la ressource
- Déposé par : Anne-Marie Lesca, le 2012-12-07
- Auteur : David Berardan
- Origine : http://commons.wikimedia.org/wiki/File:Diagramme_potentiel_pH_du_fer.PNG
- Licence : gfdl
- Format : image/png
- Type : Dessins et plans
- Collection :
- Description ScolomFR : http://data.abuledu.org/LOM/doc0000005642.xml
Téléchargement
512 - 1024 - Fichier Original - Source + Métadonnées SCOLOMFR
Relations et mots clés
Métaux, Dessins et plans, Protection, Corrosion, Oxyde ferreux, Corrosion électrochimique, Diagrammes, Matériaux résistant à la corrosion, Stabilité